Inti dari kepatuhan IVDR adalah pembentukan dan pemeliharaan Sistem Manajemen Mutu (QMS) yang kuat . Panduan ini bertujuan untuk menjelaskan persyaratan peraturan untuk perangkat IVD, memberikan wawasan untuk memastikan kepatuhan QMS, menyelidiki strategi manajemen risiko, membahas kewajiban pengawasan pasca-pemasaran, dan menawarkan kiat dan rekomendasi untuk mencapai kepatuhan penuh.
Persyaratan QMS dalam IVDR
IVDR menetapkan beberapa persyaratan penting untuk QMS. Berikut adalah elemen-elemen kunci yang harus dipenuhi:
- Kepemimpinan dan Komitmen Manajerial: Manajemen puncak harus menunjukkan komitmen terhadap QMS dan memastikan semua sumber daya yang diperlukan tersedia.
- Dokumentasi Sistem: Harus ada dokumentasi yang jelas dan terstruktur mengenai prosedur, kebijakan, dan proses yang diterapkan.
- Manajemen Risiko: QMS harus mencakup proses manajemen risiko yang efektif untuk mengidentifikasi, mengevaluasi, dan mengendalikan risiko yang terkait dengan perangkat.
- Pengendalian Kualitas: Prosedur pengendalian kualitas harus diterapkan untuk memastikan bahwa perangkat memenuhi spesifikasi yang ditetapkan.
- Peningkatan Berkelanjutan: Sistem harus memungkinkan penilaian dan perbaikan berkelanjutan berdasarkan umpan balik dan hasil audit.
Cara Memenuhi Persyaratan: Mulailah dengan melakukan penilaian menyeluruh terhadap sistem yang ada. Sesuaikan dokumentasi, proses, dan pelatihan untuk memenuhi standar IVDR. Pastikan ada dokumentasi yang lengkap dan sistematis mengenai setiap aspek QMS.
Proses Dokumentasi dan Pelaporan
Dokumentasi dan pelaporan adalah bagian integral dari QMS dalam kerangka IVDR. Berikut adalah langkah-langkah yang harus diikuti:
- Dokumentasi Sistem: Buat dokumentasi yang mencakup prosedur operasional standar (SOP), kebijakan, dan catatan yang relevan. Dokumentasi harus diperbarui secara berkala dan disimpan dengan aman.
- Pelaporan Insiden dan Non-Kepatuhan: Setiap insiden atau ketidakpatuhan harus dilaporkan secara tepat waktu. Buat sistem pelaporan yang memungkinkan identifikasi dan tindak lanjut insiden.
- Laporan Evaluasi: Secara rutin, buat laporan evaluasi mengenai efektivitas QMS dan kesesuaiannya dengan persyaratan IVDR.
Cara Melakukan Dokumentasi dan Pelaporan: Gunakan software manajemen dokumen untuk menyimpan dan mengelola dokumentasi dengan baik. Tetapkan prosedur untuk pelaporan yang jelas dan pastikan semua karyawan memahami pentingnya pelaporan yang akurat.
Peran Manajemen Puncak
Manajemen puncak memiliki peran krusial dalam pengembangan, implementasi, dan pemeliharaan QMS sesuai dengan IVDR. Tanggung jawab mereka meliputi:
- Kepemimpinan dan Dukungan: Memberikan dukungan penuh dan arahan strategis untuk QMS.
- Penetapan Kebijakan: Menetapkan kebijakan yang mendukung pencapaian tujuan kualitas dan kepatuhan terhadap IVDR.
- Alokasi Sumber Daya: Menyediakan sumber daya yang diperlukan untuk pelaksanaan QMS yang efektif.
- Tinjauan Manajemen: Melakukan tinjauan rutin terhadap QMS untuk memastikan kesesuaiannya dan melakukan penyesuaian bila diperlukan.
Cara Melakukan Peran Ini: Manajemen puncak harus terlibat aktif dalam perencanaan dan pelaksanaan QMS. Mereka perlu menyusun kebijakan yang jelas dan mendukung inisiatif kualitas dengan memberikan sumber daya dan pelatihan yang memadai.
Evaluasi Risiko dan Tindakan Korektif
Evaluasi risiko dan tindakan korektif adalah elemen penting dalam QMS. IVDR mengharuskan perusahaan untuk:
- Mengidentifikasi Risiko: Menilai potensi risiko yang mungkin mempengaruhi perangkat medis dan proses operasional.
- Menilai dan Mengendalikan Risiko: Melakukan evaluasi untuk menentukan dampak risiko dan mengimplementasikan langkah-langkah pengendalian yang sesuai.
- Tindakan Korektif: Mengidentifikasi akar penyebab ketidakpatuhan atau masalah dan mengambil tindakan untuk memperbaiki dan mencegah terulangnya masalah.
Cara Melakukan Evaluasi Risiko dan Tindakan Korektif: Gunakan metode analisis risiko seperti FMEA (Failure Modes and Effects Analysis) untuk menilai risiko. Dokumentasikan setiap tindakan korektif dan tindak lanjuti dengan proses verifikasi untuk memastikan efektivitasnya.
Langkah-Langkah Audit Internal
Audit internal merupakan bagian penting untuk memastikan kepatuhan terhadap IVDR. Langkah-langkah yang harus diambil termasuk:
- Perencanaan Audit: Menyusun rencana audit yang mencakup area-area yang akan diaudit dan kriteria evaluasi.
- Pelaksanaan Audit: Melakukan audit sesuai dengan rencana yang telah dibuat, termasuk pemeriksaan dokumentasi dan wawancara dengan staf.
- Laporan Hasil Audit: Menyusun laporan audit yang mendokumentasikan temuan dan rekomendasi.
- Tindakan Tindak Lanjut: Mengambil tindakan berdasarkan hasil audit untuk mengatasi temuan dan memastikan perbaikan yang diperlukan.
Cara Melakukan Audit Internal: Gunakan checklist dan panduan audit untuk memastikan cakupan yang komprehensif. Libatkan auditor yang berpengalaman dan independen untuk memberikan perspektif objektif.
Persyaratan Regulasi untuk IVD di UE
Berdasarkan IVDR, IVD dikategorikan berdasarkan risiko yang ditimbulkannya terhadap pasien, tenaga kesehatan, dan kesehatan masyarakat. Peraturan tersebut mengklasifikasikan perangkat ke dalam Kelas A, B, C, dan D, dengan tingkat pengawasan dan persyaratan yang semakin ketat sesuai dengan kelas risiko. Produsen harus mematuhi standar yang ketat untuk desain, manufaktur, evaluasi kinerja klinis, dan pengawasan pasca-pemasaran.
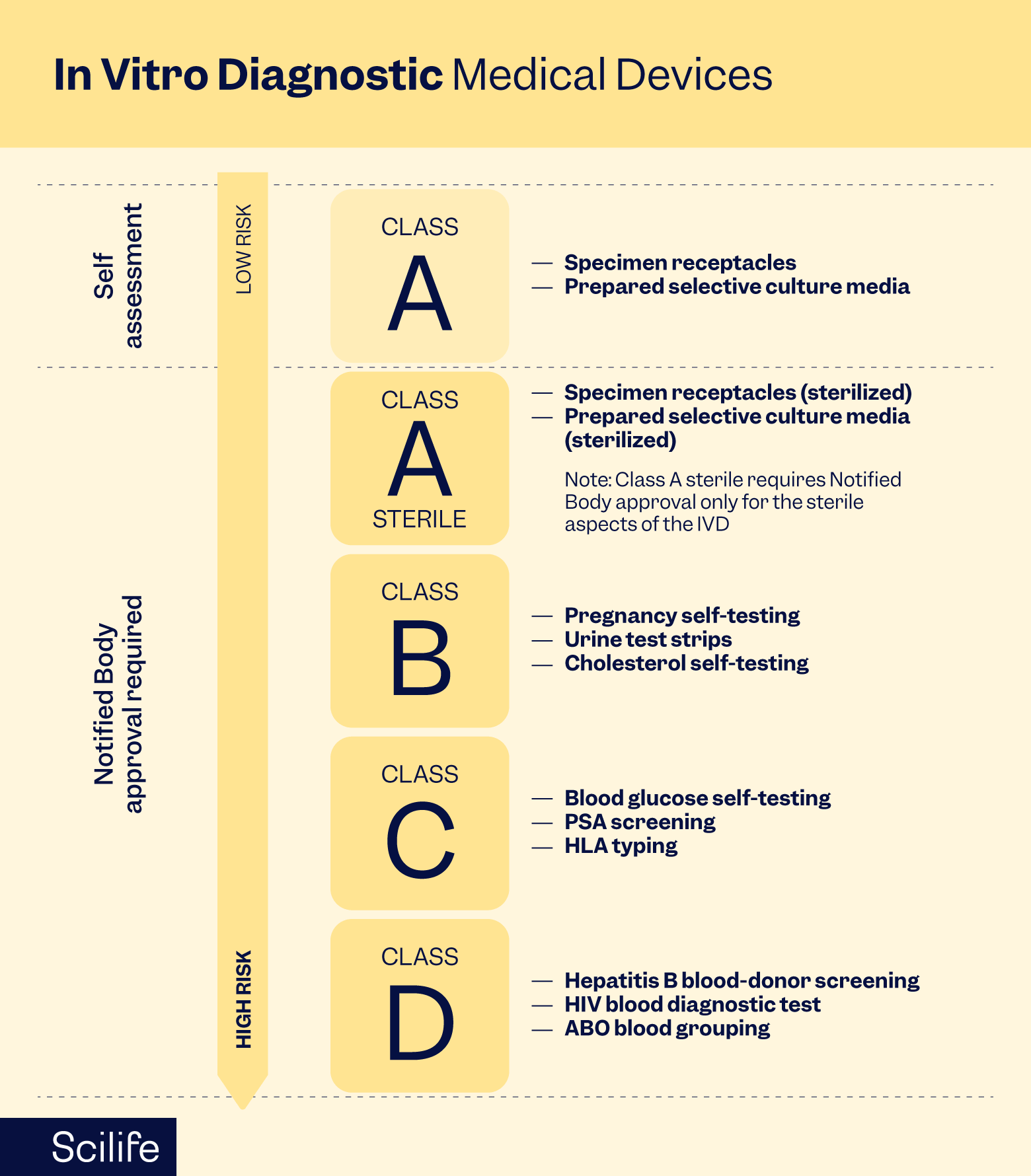
Cara Memastikan Kepatuhan QMS Anda
Menetapkan QMS yang disesuaikan dengan persyaratan IVDR sangat penting untuk kepatuhan. Hal ini melibatkan penetapan peran dan tanggung jawab organisasi, pendokumentasian prosedur, penerapan proses manajemen risiko, dan memastikan ketertelusuran di seluruh siklus hidup perangkat.
Komponen utama dari QMS yang efektif meliputi:
- Kontrol Dokumen : Menjaga catatan akurat tentang prosedur, instruksi kerja, dan dokumentasi teknis untuk menunjukkan kesesuaian dengan persyaratan IVDR.
- Manajemen Risiko: Terapkan pendekatan sistematis untuk mengidentifikasi, menilai, dan mengurangi risiko yang terkait dengan desain, pembuatan, dan penggunaan perangkat IVD.
- Manajemen Pemasok: Pastikan bahwa pemasok dan subkontraktor mematuhi persyaratan peraturan yang berlaku dan menyediakan dokumentasi yang diperlukan untuk mendukung kualitas dan keamanan komponen dan material.
- Tindakan Korektif dan Pencegahan (CAPA) : Menetapkan prosedur untuk menyelidiki ketidaksesuaian, menerapkan tindakan perbaikan, dan mencegah terulangnya kembali guna terus meningkatkan kualitas dan keselamatan produk.
- Pelatihan dan Kompetensi: Memberikan pelatihan berkelanjutan kepada personel yang terlibat dalam desain, pembuatan, pengujian, dan distribusi perangkat IVD untuk memastikan mereka memiliki keterampilan dan pengetahuan yang diperlukan untuk menjalankan peran mereka secara efektif.
Manajemen Risiko
Manajemen risiko memegang peranan penting dalam memastikan keamanan dan kinerja perangkat IVD sepanjang siklus hidupnya. Produsen harus melakukan penilaian risiko yang komprehensif untuk mengidentifikasi potensi bahaya, mengevaluasi tingkat keparahan dan kemungkinan bahaya, serta menerapkan langkah-langkah untuk mengurangi risiko ke tingkat yang dapat diterima.
Elemen utama manajemen risiko di bawah IVDR meliputi:
- Identifikasi Bahaya: Identifikasi dan cirikan potensi bahaya yang terkait dengan perangkat, termasuk bahaya biologis, kimia, dan fisik, serta kesalahan penggunaan dan kegagalan perangkat lunak.
- Penilaian Risiko : Mengevaluasi tingkat keparahan bahaya yang dapat ditimbulkan dari setiap bahaya yang teridentifikasi, dengan mempertimbangkan faktor-faktor seperti tujuan penggunaan perangkat, karakteristik populasi sasaran, dan kemungkinan paparan.
- Pengendalian Risiko: Terapkan tindakan untuk menghilangkan atau mengurangi risiko yang teridentifikasi ke tingkat yang dapat diterima, seperti modifikasi desain, tindakan perlindungan, atau peringatan dan tindakan pencegahan.
- Komunikasi Risiko: Komunikasikan dengan jelas risiko residual kepada pengguna, profesional perawatan kesehatan, dan otoritas regulasi melalui pelabelan, petunjuk penggunaan, dan dokumentasi relevan lainnya.
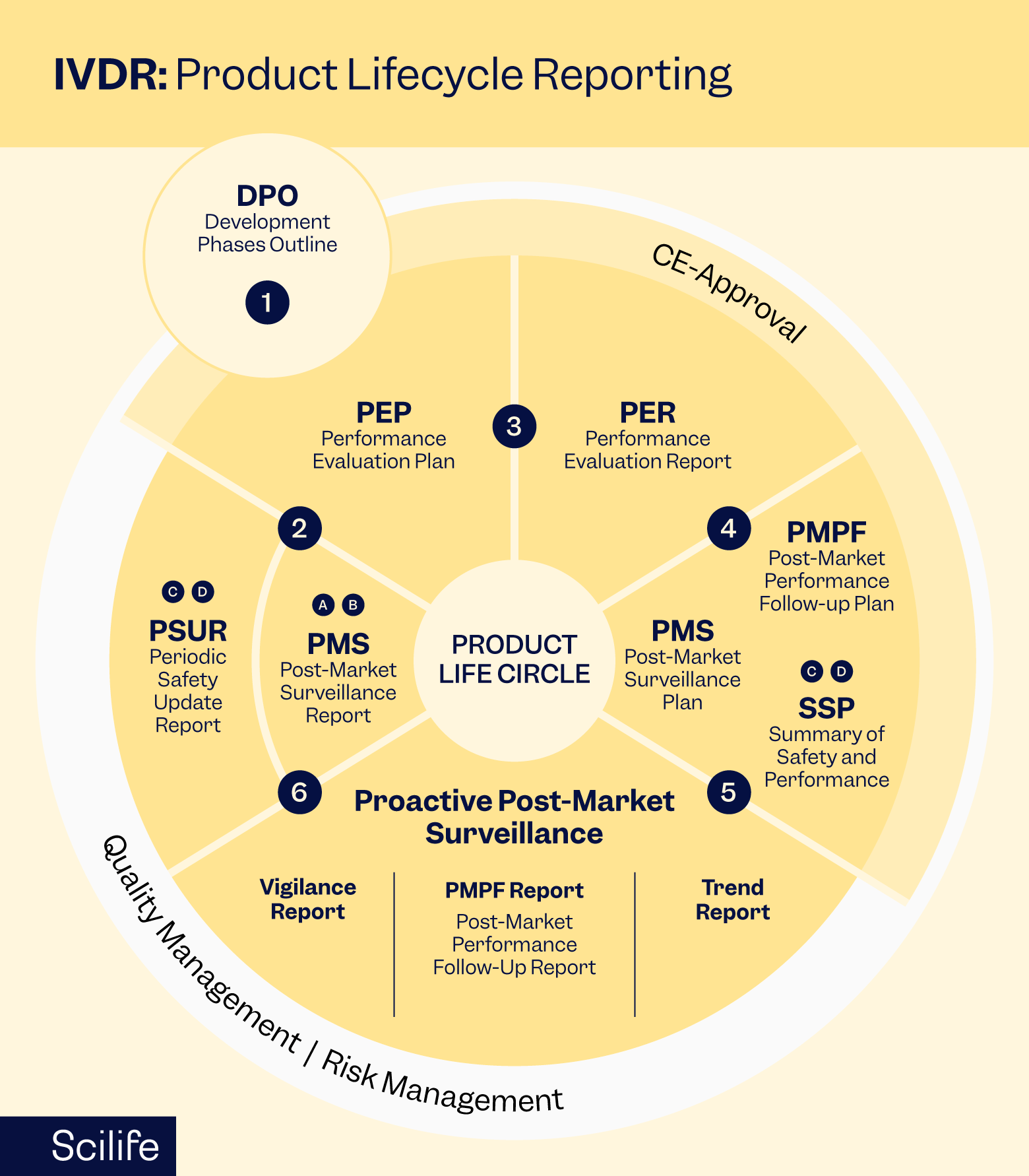
Pengawasan Pasca Pasar
Pengawasan pasca-pemasaran (PMS) sangat penting untuk memantau kinerja dan keamanan perangkat IVD setelah dipasarkan. Produsen diharuskan membuat sistem PMS untuk mengumpulkan, menganalisis, dan menindaklanjuti data yang terkait dengan penggunaan perangkat mereka di dunia nyata.
Komponen utama PMS meliputi:
- Pelaporan Kewaspadaan: Segera laporkan setiap insiden, termasuk kejadian buruk yang serius dan kegagalan fungsi perangkat, kepada otoritas yang berwenang dan beri tahu pengguna yang terdampak sebagaimana perlu.
- Laporan Pembaruan Keamanan Berkala (PSUR): Menyiapkan dan menyerahkan PSUR secara berkala untuk memberikan pembaruan tentang keamanan dan kinerja perangkat IVD berdasarkan data pengawasan pasca-pemasaran.
- Tindak lanjut klinis pascapemasaran (PMCF): memantau dan menganalisis informasi klinis untuk memastikan keamanan dan kemanjuran perangkat Anda yang berkelanjutan dalam pengaturan klinis.
- Analisis Tren: Pantau tren keluhan, kejadian buruk, dan data relevan lainnya untuk mengidentifikasi risiko atau masalah yang muncul yang mungkin memerlukan tindakan perbaikan.
- Peningkatan Berkelanjutan: Gunakan data pengawasan pasca-pemasaran untuk mendorong inisiatif peningkatan berkelanjutan, seperti modifikasi desain, pembaruan pelabelan, atau pelatihan tambahan bagi pengguna.
Tips dan Rekomendasi untuk Mematuhi Aturan Sepenuhnya
Mencapai kepatuhan penuh terhadap persyaratan IVDR memerlukan pendekatan yang proaktif dan komprehensif. Berikut adalah beberapa kiat dan rekomendasi untuk membantu Anda menavigasi lanskap regulasi secara efektif:
- Mulai Lebih Awal: Mulailah transisi ke kepatuhan IVDR jauh sebelum batas waktu transisi untuk memberikan waktu yang cukup untuk implementasi dan validasi proses QMS.
- Berinteraksi dengan Badan Terverifikasi: Berkolaborasilah dengan badan terverifikasi di awal proses untuk mendapatkan wawasan tentang harapan dan persyaratan mereka untuk sertifikasi IVDR.
- Berinvestasi dalam Pelatihan: Berikan pelatihan kepada personel kunci mengenai persyaratan IVDR, prinsip QMS, teknik manajemen risiko, dan topik relevan lainnya untuk memastikan pemahaman menyeluruh tentang kewajiban kepatuhan.
- Memanfaatkan Teknologi: Jelajahi solusi perangkat lunak dan peralatan digital untuk menyederhanakan proses QMS, memfasilitasi manajemen dokumentasi, dan meningkatkan keterlacakan dan transparansi.
- Tetap Terinformasi: Ikuti terus pembaruan dan panduan dari otoritas regulasi, asosiasi industri, dan sumber relevan lainnya untuk memastikan kepatuhan berkelanjutan terhadap persyaratan yang terus berkembang.
Kesimpulan
Kepatuhan terhadap IVDR sangat penting bagi produsen perangkat IVD yang ingin memasuki pasar Eropa. Dengan membangun QMS yang kuat, menerapkan strategi manajemen risiko yang efektif, melakukan pengawasan pasca-pemasaran yang ketat, dan mengikuti praktik terbaik untuk kepatuhan, produsen dapat menavigasi lanskap regulasi dengan percaya diri dan memastikan keamanan dan kemanjuran produk mereka. Seiring dengan semakin dekatnya tenggat waktu penerapan IVDR, langkah proaktif yang diambil sekarang dapat membuka jalan bagi sertifikasi yang berhasil dan akses pasar yang berkelanjutan untuk perangkat medis Anda di Uni Eropa.





Tidak ada komentar:
Posting Komentar