Audit dan inspeksi merupakan bagian dari siklus hidup manajemen mutu, keduanya merupakan fakta kehidupan dalam industri peralatan medis dan farmasi. Tujuan inspeksi Sistem Manajemen Mutu adalah untuk memastikan perusahaan Anda telah menetapkan proses dan prosedur yang diperlukan dalam sistem manajemen mutu (QMS) Anda, dan bahwa proses dan prosedur tersebut dipatuhi.
Mari pelajari bagaimana FDA CFR Judul 21 mendefinisikan istilah umum seperti audit dan inspeksi.
“Bagian 820.22 Audit Mutu: Setiap produsen harus menetapkan prosedur untuk audit mutu dan melaksanakan audit tersebut untuk memastikan bahwa sistem mutu mematuhi persyaratan sistem mutu yang ditetapkan dan untuk menentukan efektivitas sistem mutu. Audit mutu harus dilaksanakan oleh individu yang tidak memiliki tanggung jawab langsung atas hal-hal yang diaudit. Tindakan perbaikan, termasuk audit ulang atas hal-hal yang kurang, harus dilakukan bila perlu. Laporan hasil setiap audit mutu, dan audit ulang jika dilakukan, harus dibuat dan laporan tersebut harus ditinjau oleh manajemen yang bertanggung jawab atas hal-hal yang diaudit. Tanggal dan hasil audit mutu dan audit ulang harus didokumentasikan.”
Pemeriksaan , sebagaimana dijelaskan dalam Pasal 704(a)(1) Undang-Undang Makanan, Obat, & Kosmetik (Food Drug & Cosmetic Act/FD&C) [21 USC 374] , melibatkan petugas atau pegawai FDA yang ditunjuk secara resmi untuk secara fisik memasuki (pada waktu yang wajar dan dengan cara yang wajar) tempat usaha yang tunduk pada peraturan di bawah Undang-Undang tersebut untuk menentukan kepatuhan terhadap persyaratan FDA yang berlaku (IOM 5.1.1).
“Badan Pengawas Obat dan Makanan (FDA) melakukan inspeksi dan penilaian terhadap fasilitas yang diatur untuk menentukan kepatuhan perusahaan terhadap hukum dan peraturan yang berlaku, seperti Undang-Undang Makanan, Obat, dan Kosmetik. Hal ini biasanya melibatkan seorang penyelidik yang mengunjungi lokasi perusahaan.”
Hari ini, kita akan membahas rincian aktivitas persiapan audit dan inspeksi serta mengajarkan Anda cara menjaga organisasi Anda tetap siap diperiksa setiap saat.
Harapan FDA terhadap Fungsi Kualitas
Peraturan Badan Pengawas Obat dan Makanan AS (FDA) menyediakan kerangka kerja untuk persyaratan mutu dasar yang harus dipatuhi oleh produsen. Dengan kerangka kerja ini, FDA menetapkan beberapa tugas Unit Mutu yang konsisten dengan pendekatan sistem mutu modern.
Banyak peraturan yang merujuk pada fungsi QC dan QA sebagai unit mutu, di mana keduanya bertindak bersama sebagai badan pengatur untuk fasilitas manufaktur, memastikan kepatuhan terhadap praktik manufaktur yang baik ( GMP ). Ini berarti unit mutu memastikan pengembangan dan penerapan prosedur operasi standar (SOP) dan proses yang tepat mulai dari penerimaan bahan baku dan komponen hingga pelepasan produk akhir yang diproduksi.
QC biasanya melibatkan hal-hal berikut ini:
- menilai kesesuaian komponen yang masuk, wadah, penutup, pelabelan, bahan dalam proses, dan produk akhir;
- mengevaluasi kinerja proses manufaktur untuk memastikan kepatuhan terhadap spesifikasi dan batasan yang tepat; dan
- menentukan penerimaan setiap batch untuk dirilis.
QA terutama melibatkan hal-hal berikut ini:
- peninjauan dan persetujuan semua prosedur yang terkait dengan produksi dan pemeliharaan,
- meninjau catatan terkait, dan
- audit dan melakukan/mengevaluasi analisis tren.
Jenis-jenis Inspeksi FDA
Catatan tentang terminologi: Ketika FDA datang, itu adalah inspeksi, bukan audit, meskipun orang mungkin menyebutnya sebagai audit dan inspektur FDA sebagai auditor. Inspeksi oleh inspektur FDA akan menentukan apakah QMS Anda mematuhi 21 CFR Bagian 820, yang juga dikenal sebagai Peraturan Sistem Mutu (QSR).
Inspeksi rutin FDA akan dilakukan setidaknya dua tahun sekali. Namun, temuan apa pun pada inspeksi rutin dapat mengakibatkan inspeksi tindak lanjut kepatuhan untuk memverifikasi bahwa Anda telah mengatasi masalah tersebut.
Terkadang, inspektur FDA datang tanpa pemberitahuan dan memiliki wewenang untuk menutup perusahaan Anda saat itu juga. Dengan sikap yang tepat terhadap kualitas dan perangkat lunak QMS, tidak ada alasan untuk khawatir saat inspektur FDA datang.
Badan Pengawas Obat dan Makanan (FDA) melakukan beberapa jenis inspeksi untuk memastikan bahwa konsumen dan pasien memiliki akses ke produk yang dibutuhkan (obat-obatan dan peralatan medis). Inspeksi terbagi dalam empat kategori umum yang dapat diharapkan oleh produsen:
#1 Pengawasan (juga disebut inspeksi rutin)
Ini adalah inspeksi standar yang dilakukan dua tahun sekali untuk perusahaan dalam negeri atau produsen perangkat Kelas II dan Kelas III, dan sekitar sembilan tahun sekali untuk fasilitas asing. Jika ditemukan pelanggaran tetapi tindakan perbaikan segera diambil untuk mengatasi masalah tersebut saat inspektur FDA hadir, ini akan dicatat sebagai indikator positif dari komitmen perusahaan untuk tetap patuh. Inspeksi ini dilakukan untuk secara umum menentukan atau memantau apakah produsen mematuhi praktik produksi yang bermutu.
#2 Tindak lanjut kepatuhan
Jika ditemukan pelanggaran selama inspeksi, pelanggaran tersebut akan dicantumkan pada Formulir FDA 483. Setelah itu, FDA akan melakukan inspeksi ulang untuk memverifikasi bahwa masalah yang diamati sebelumnya telah diselesaikan.
#3 Inspeksi berbasis aplikasi (Pra-persetujuan, pra-pasaran, atau pra-lisensi)
Pemeriksaan ini dilakukan, bila perlu, sebagai bagian dari peninjauan permohonan untuk memasarkan produk baru guna menentukan apakah produk tersebut diproduksi sesuai dengan peraturan FDA dan untuk memastikan fasilitas tersebut mampu memproduksi produk secara konsisten dan bahwa data yang diserahkan akurat dan lengkap. Sekitar 20% peninjauan permohonan dilakukan oleh lembaga tersebut.
#4 Inspeksi karena sebab tertentu
Mereka dipicu saat ada alasan untuk meyakini suatu fasilitas memiliki masalah kualitas/produksi yang serius, untuk menyelidiki masalah tertentu/keluhan produk yang telah menjadi perhatian FDA, atau untuk mengevaluasi perbaikan yang telah dilakukan untuk mengatasi pelanggaran sebelumnya.
Badan tersebut juga melakukan inspeksi untuk memverifikasi keandalan, integritas, dan kepatuhan penelitian klinis dan non-klinis yang sedang ditinjau untuk mendukung aplikasi yang tertunda.
Inspeksi dapat berupa tinjauan menyeluruh terhadap keseluruhan operasi di suatu fasilitas atau dapat diarahkan, terkadang disebut sebagai inspeksi terbatas, pada satu atau beberapa masalah tertentu, seperti untuk memastikan kepatuhan terhadap tindakan penarikan kembali atau untuk menindaklanjuti tindakan perbaikan di fasilitas tersebut.
Tantangan: Bagaimana mempersiapkan inspeksi
Biasanya, Anda akan menerima pengumuman setidaknya 5 hari sebelum pemeriksaan. Pemeriksaan diumumkan dalam sebagian besar kasus, dan Anda akan memiliki waktu persiapan tambahan sebelum inspektur datang.
Namun, di AS, FDA dikenal sering datang tanpa pemberitahuan. Ini berarti Anda harus selalu siap untuk diperiksa. Jadi, bagaimana Anda dapat mempersiapkan diri untuk audit?
Tips Mempersiapkan Inspeksi FDA yang Sukses
Persiapan yang baik membantu memastikan bahwa inspeksi Anda berjalan lancar dan semua masalah tercakup. Namun, mungkin ada saatnya Anda tidak dapat melakukan peninjauan menyeluruh terhadap semua materi atau informasi inspeksi sebelum inspeksi. Simak kiat-kiat terbaik untuk mempersiapkan inspeksi QMS, yang kami cantumkan khusus untuk Anda, dan pastikan Anda melakukannya saat mempersiapkan inspeksi berikutnya.
Tip #1: Miliki jawaban untuk semua pertanyaan potensial terlebih dahulu
Akan bermanfaat untuk melakukan kegiatan berikut sebelum melakukan inspeksi:
- Tinjau semua dokumentasi yang mungkin diminta oleh inspektur FDA dan pastikan bahwa dokumen terorganisir dan mudah diakses.
- Hal pertama yang mulai ditinjau oleh inspektur adalah riwayat perusahaan. Jadi, Anda harus memulai kontrol dengan meninjau riwayat perusahaan Anda, termasuk semua keluhan sebelumnya, penarikan kembali produk, peringatan keselamatan pribadi, dll. Tujuan dari tinjauan ini adalah untuk memperoleh gambaran umum tentang operasi dan produk Anda, memahami riwayat kepatuhan Anda, dan bersiap menghadapi pertanyaan potensial dengan bukti. Melakukan tinjauan keluhan akan membantu Anda mengidentifikasi keluhan yang memerlukan tindak lanjut selama inspeksi Anda.
- Anda juga harus meninjau berkas pendirian untuk menentukan apakah ada masalah keselamatan yang tercatat sebelumnya, misalnya, setiap insiden keselamatan penyelidik yang terdokumentasi atau saran untuk peralatan perlindungan diri khusus yang diperlukan sebelum dimulainya inspeksi.
- Bagian dukungan untuk pemeriksaan sebelumnya, dan harus disertai dengan memo ke arsip perusahaan.
- Jika pemeriksaan dilakukan sebagian atau semata-mata sebagai tindak lanjut atas penarikan kembali produk atau keluhan konsumen, Anda juga harus berencana untuk meninjau program kepatuhan yang berlaku sebelum memulai pemeriksaan. Selain itu, pusat-pusat telah menerbitkan sejumlah dokumen panduan untuk industri, yang juga harus Anda pahami.
Tip#2: Selalu siap untuk diperiksa
Mempertahankan QMS yang siap diperiksa bukan hanya soal mengubah prosedur operasi standar—tetapi juga soal membangun budaya mutu di dalam perusahaan Anda. Organisasi, yang setiap orangnya memahami bahwa mutu bukan hanya urusan departemen mutu, cenderung dapat melewati audit tanpa temuan apa pun.

Anda dapat mulai membangun budaya mutu dan mempersiapkan audit QMS berikutnya dengan mengambil langkah-langkah ini.
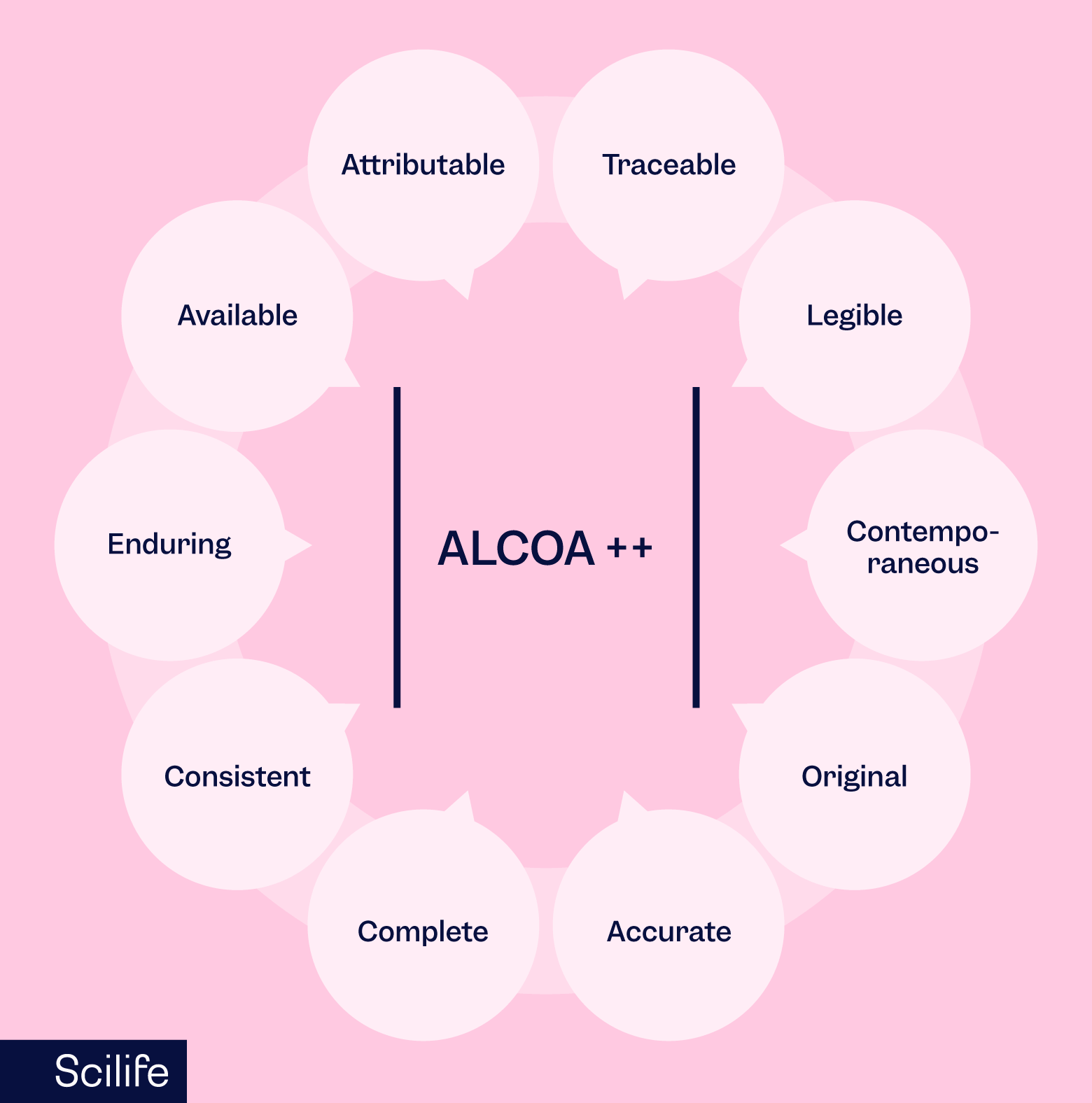
Anda tidak boleh melakukan pekerjaan Anda dari perspektif bahwa pekerjaan tersebut mungkin akan diaudit atau diperiksa”, Anda melakukannya dengan benar sejak awal dengan harapan ALCOA++. Gagasan bahwa Anda harus:
- dokumentasikan semua hal saat Anda mengerjakan tugas (dan jangan setelahnya)
- file/struktur dalam aliran (dan bukan yang lebih baru)
- mengatur semuanya dengan harapan ALCOA++
Tip #3: Ketahui peran Anda
Inspektur biasanya cenderung menanyakan pertanyaan-pertanyaan berikut secara langsung atau tidak langsung, jadi bersiaplah untuk menjawab:
- Siapa kamu?
- Apa pekerjaanmu?
- Apa peran Anda dalam…?
- Bagaimana Anda dilatih?
- Proses apa yang Anda ikuti?
- Apakah ada kekhawatiran?
Setiap individu di organisasi Anda - bisa jadi seorang pekerja atau kepala departemen - harus mengetahui jawaban atas pertanyaan-pertanyaan ini. Tiga pertanyaan pertama sangat mudah dijawab, tetapi di bawah tekanan, orang mungkin akan terjerat dalam pikiran tentang apa pekerjaan mereka dan apa peran spesifik mereka dalam aktivitas tertentu yang mungkin hanya merupakan bagian dari pekerjaan yang terkadang sulit dijawab - setidaknya selama pelaksanaan proses ini. Jadi, Anda dan setiap orang di organisasi Anda harus memikirkan pertanyaan-pertanyaan ini dan bersiap untuk menjawabnya terlebih dahulu.
Tip#4: Ketahui apa yang terjadi, kapan, di mana…
Tujuan inspeksi adalah untuk mencari jawaban atas pertanyaan-pertanyaan berikut:
- Apa yang dilakukan?
- Siapa yang melakukannya?
- Bagaimana hal itu dilakukan?
- Mengapa hal itu dilakukan?
- Kapan itu terjadi?
- Dimana terjadinya?
Untuk menjawab pertanyaan ini, Anda harus mengetahui:
- masalah, kekhawatiran, atau isu apa pun yang mungkin terjadi
- segarkan ingatan Anda jika diperlukan
- di mana informasi disimpan, bagaimana cara mengaksesnya
- siapa yang harus dieskalasi
Sebagai seorang profesional yang berkualitas, Anda dapat menjadi koordinator inspeksi kualitas atau anggota tim kualitas di organisasi Anda. Anda harus mengingat kembali dan menyegarkan ingatan Anda sebagai praktik yang baik, terutama jika Anda pernah diperiksa sebelumnya. Anda mungkin perlu mengetahui masalah, informasi tempat penyimpanannya, dan cara mengaksesnya. Jika masalah terjadi di masa lalu, Anda mungkin kehilangan akses ke sistem tersebut karena sudah lama berlalu. Oleh karena itu, aktivitas ini akan membantu Anda memeriksa apakah Anda perlu mendapatkan kredensial login baru.
Tip#5: Persiapan lokasi sebelum audit

Biasanya, orang-orang melakukan banyak persiapan dalam hal bagaimana mempersiapkan diri untuk wawancara. Hal penting lainnya adalah mempersiapkan diri dalam hal logistik.
- Tetapkan tanggung jawab
- Pencatat: seseorang yang hadir di ruangan saat wawancara. Mencatat semua pertanyaan dan jawaban dengan seseorang yang berada di ruangan kedua untuk menyoroti serta melakukan inspeksi
- Koordinator Kualitas
- Koordinator Inspektur
- Tentukan & Siapkan ruangan
- Ruang untuk para inspektur: mereka ingin memiliki ruang terpisah untuk bekerja
- Ruang kedua untuk tim: tempat Anda dapat menyiapkan dokumen dan wawancara, di mana Anda memiliki seseorang untuk membantu inspektur jika ada pertanyaan. Idealnya, ruangan tersebut sedekat mungkin sehingga Anda dapat melihat apa yang sedang dilakukan inspektur dan apakah dan kapan mereka meninggalkan lokasi yang ditugaskan.
- Menyiapkan dokumen & materi
Biasanya ini adalah informasi yang terkait dengan sistem manajemen mutu.
-
- Satu pemeriksaan terakhir pada dokumen dan materi yang diminta dan dibutuhkan pada hari pemeriksaan. Jika berupa berkas atau folder berbasis kertas, pindahkan ke ruang sekunder terlebih dahulu.
- Hari pemeriksaan sebelum mereka datang, berjalanlah melintasi lokasi dan singkirkan kertas-kertas yang tertinggal di printer, pengumuman, atau papan pengumuman terutama jika itu adalah catatan lama atau catatan pribadi.
- jika Anda memiliki meja resepsionis, beritahu mereka bahwa akan ada inspektur dan siapa yang harus mereka hubungi saat mereka tiba di lokasi, apa yang terjadi selama wawancara, dll.
Tip#6: Tur fasilitas
Ini adalah langkah yang dilakukan oleh para inspektur. Saran kami untuk Anda adalah melakukan gladi bersih tur fasilitas. Anda dapat bertindak seolah-olah Anda sedang mendampingi para inspektur untuk tur ke semua lokasi yang termasuk dalam agenda inspeksi (jika disediakan sebelumnya). Anda berjalan ke semua ruangan, dan lokasi yang termasuk dalam cakupan dan membuka setiap pintu dan lemari, memeriksa setiap papan, label, dll., memastikan semuanya terkontrol dan tidak ada yang mungkin bermasalah.
Berikut ini adalah beberapa hal yang sangat kami rekomendasikan selama tur fasilitas:
- Mengikuti alur keluar dari kursus pada topik yang dihadiri jika memungkinkan dan praktis
- Anda sebagai koordinator inspeksi/pimpinan mutu yang akan memandu inspektur. Anda harus terus memimpin tur dan menghindari mereka mengambil alih pimpinan dan membuka pintu, serta memasuki area yang tidak ingin Anda tampilkan atau yang tidak termasuk dalam cakupan.
- Selama tur, tugaskan seseorang untuk mencatat bangunan dan ruangan mana yang telah mereka kunjungi serta pertanyaan dan jawaban yang diberikan selama tur.
- Minta inspektur untuk tidak mengambil gambar atau video apa pun di tempat selama inspeksi karena kebijakan organisasi. Terkadang mereka mungkin ingin mengambil gambar, misalnya, gambar suatu tempat. Pastikan Anda memiliki foto yang sama dari tempat yang sama, oleh karena itu Anda akan tahu persis apa yang mereka miliki dan apa yang telah mereka lihat.
Tip#7: Tinjauan Dokumen dan Data
Selama inspeksi, inspektur meminta Anda untuk memberikan dokumen dan data. Seseorang (atau terkadang lebih dari satu orang) dari bagian kualitas bertanggung jawab untuk menemukan dan memberikan dokumen dan data yang diminta. Orang yang bertanggung jawab untuk ini dan perwakilan kualitas atau koordinator inspeksi harus memperhatikan kiat-kiat berikut:
- Jika mereka meminta catatan acak sebagai contoh, berikan catatan yang lengkap dan periksa catatan tersebut terlebih dahulu untuk mengetahui adanya ketidaksesuaian, bidang yang hilang, tanda tangan, dll.
- Berikan dokumen atau data kepada perwakilan mutu atau koordinator audit/inspeksi, jangan berikan catatan langsung kepada inspektur.
- Pertahankan alur dokumen yang baik dan jangan menunda penyediaan dokumen.
- Sebaiknya, ruang sekunder terdekat untuk tim mutu akan membantu Anda dalam hal ini.
- Permintaan dokumen dapat diajukan sebelum inspeksi, pada rapat pembukaan, selama wawancara, atau secara ad hoc selama peninjauan dokumen (berkelanjutan). Perwakilan mutu harus memiliki komunikasi yang jelas dan cepat melalui pesan atau telepon agar dapat segera menyampaikan apa yang diminta.
- Menyimpan pelacak dokumen beserta ID dan versinya yang disediakan.
Tip#8: Pertahankan kepatuhan dengan melakukan audit internal yang efektif
Memiliki tim audit internal yang andal dan terlatih dengan baik dapat membantu Anda mengaudit semua proses internal secara efektif. Anda akan kehilangan kesempatan berharga untuk meningkatkan proses internal dan menemukan masalah yang dapat mengakibatkan temuan selama inspeksi FDA.
Apakah Anda lebih suka mencari dan memperbaiki sendiri masalahnya daripada membiarkan FDA memeriksa fasilitas Anda dan mengeluarkan surat peringatan atau Formulir 483? Tampaknya tidak perlu diragukan lagi.
Apa yang diharapkan dan bagaimana menanggapinya.
Terkadang terasa seperti tujuan utama adalah untuk menemukan jawaban atas pertanyaan "siapa yang melakukannya?" Khususnya, FDA memiliki reputasi untuk datang dengan gagasan bahwa pasti ada masalah dan mereka akan menemukan bahwa bagaimanapun, itu bukanlah tujuan utama mereka. Mari kita lihat lebih dekat bagaimana menanggapi wawancara dan perilaku apa yang harus kita perhatikan:
1. Tetap tenang dan profesional
Pertahankan sikap tenang dan profesional selama pemeriksaan.
JANGAN berdebat atau menantang inspektur FDA; fokuslah pada penyediaan informasi yang akurat.
2. Dengarkan pertanyaannya
Dengarkan pertanyaannya. Jika perlu, ulangi dengan kata-kata Anda sendiri, atau mintalah klarifikasi.
JANGAN menafsirkan, menguraikan, atau menebak.
Lebih baik mencari kejelasan daripada memberikan informasi yang salah.
3. Jawab pertanyaannya SAJA
Jawab HANYA pertanyaan yang diajukan. Jujur, faktual, dan ringkas.
JANGAN memberikan informasi secara sukarela di luar apa yang diminta.
Auditor biasanya menggunakan salah satu teknik wawancara yang paling umum yaitu diam. Teknik ini mengundang elaborasi, dan orang tidak suka diam saat berbicara dengan seseorang, mereka ingin percakapan mengalir. Jadi auditor yang terampil menggunakan diam dan Anda mungkin cenderung untuk langsung menjawabnya dengan informasi lebih banyak daripada yang mereka minta. Alih-alih memberikan informasi lebih banyak, Anda dapat mengatakan, "Saya rasa ini menjawab pertanyaan Anda", dan kemudian diamnya kembali ke auditor.
4. Katakan jika Anda tidak yakin
Jika Anda TIDAK YAKIN dengan jawabannya: tidak apa-apa untuk mengatakannya. Tunjukkan bahwa Anda akan mencoba menemukan/mengkonfirmasi jawaban yang benar dan memberikannya nanti. Rujuk ke kolega lain.
JANGAN mengarang hal baru, atau mencoba menjawab sendiri jika pertanyaan tersebut bukan milik Anda untuk dijawab.
5. Bekerjasama dan bersikap transparan
Bekerja sama dan bersikaplah transparan sepenuhnya dengan inspektur FDA, dengan memberikan semua informasi yang diminta. Transparansi dan keterbukaan sangat penting dalam membangun kepercayaan. Informasi yang saling bertentangan selalu bermasalah. Oleh karena itu, bersikaplah jujur dan lengkap, serta rujuk dokumen dan proses yang diperlukan untuk dukungan.
Terkadang inspektur dapat mewawancarai lebih dari satu orang mengenai subjek yang sama. Artinya, mereka mengajukan pertanyaan yang jawabannya sudah mereka ketahui dan mengonfirmasi jika ada informasi yang bertentangan. Oleh karena itu, sangat penting bagi setiap orang untuk menjawab pertanyaan dengan benar sesuai dengan dokumentasi. Dengan cara itu, tidak akan ada konflik atau setidaknya sesedikit mungkin konflik antara dua orang yang diwawancarai. JANGAN menyesatkan dengan jawaban Anda atau mengada-ada.
6. JANGAN berkomitmen
Anda dapat menerima saran-saran perbaikan.
JANGAN berkomitmen pada saran-saran perbaikan pada saat wawancara
7. Catat hasil pengamatan
Catat hasil pengamatan inspektur dan masalah apa pun yang teridentifikasi.
Ini penting untuk mengatasi dan memperbaiki masalah apa pun setelah inspeksi.
8. Rapat Penutupan
Akan ada rapat penutup di akhir inspeksi. Inspektur akan menyampaikan semua hasil pengamatan yang mereka peroleh selama inspeksi berlangsung. Perhatikan hal-hal berikut selama rapat penutup:
- Batasi kehadiran hanya pada staf kunci saja
- Perlakukan inspektur FDA dengan baik dengan keramahan
- Jika ada yang tidak jelas, mintalah klarifikasi tambahan
- Jika Anda merasa umpan balik tertentu tidak secara akurat mencerminkan situasi, cobalah untuk memperbaikinya pada tahap ini. Jangan terlibat dalam diskusi jika sangat diperlukan.
- Catat pengamatan atau minta untuk menerima draf lebih awal
- Konfirmasikan ke mana tanggapan terhadap pengamatan harus dikirim
- Konfirmasikan jadwal
- Ucapkan terima kasih kepada inspektur
Menangani temuan audit umum dan rencana tindakan perbaikan
Sebelum menerima laporan inspeksi
- Berdasarkan informasi pengarahan pada rapat penutupan, Anda dapat mulai mengerjakan analisis akar penyebab dan CAPA dapat diprakarsai untuk mengelola waktu Anda dengan bijak tanpa menghabiskan waktu menunggu laporan.
- Laporan tersebut mungkin berbeda dari penjelasan pada rapat penutup.
Setelah menerima laporan inspeksi
Laporan inspeksi FDA menunjukkan klasifikasi akhir menjadi 3 kategori untuk setiap area proyek dalam inspeksi:

- Tidak Ada Tindakan yang Ditunjukkan (NAI) yang berarti tidak ditemukan kondisi atau praktik yang dapat diterima selama pemeriksaan (atau kondisi yang dapat diterima yang ditemukan tidak membenarkan tindakan regulasi lebih lanjut),
- Tindakan Sukarela Terindikasi (VAI) yang berarti ditemukan kondisi atau praktik yang tidak diinginkan namun lembaga tersebut tidak siap mengambil atau merekomendasikan tindakan administratif atau regulasi, atau
- Tindakan Resmi Diindikasikan (OAI) yang berarti tindakan regulasi dan/atau administratif akan direkomendasikan.
Berbeda dengan temuan audit Eropa, FDA bekerja secara berbeda. Jika mereka benar-benar memiliki masalah, mereka akan menerbitkan Formulir 483. Jika tidak, mereka hanya akan memberi Anda umpan balik, tetapi bukan Formulir 483. Formulir 483 mencakup temuan dengan kategori yang kami cantumkan di atas. Jika itu adalah Tindakan Resmi yang Diindikasikan (OAI), Anda harus mengatasinya dalam tanggapan formal yang kembali ke FDA. Formalisasi analisis akar penyebab (RCA) dan penyusunan penyebab yang tepat lebih terletak pada item yang dianggap berdampak signifikan terhadap peraturan atau pasien atau kesetaraan obat.
Jika Anda menerima Formulir 483 , Anda harus melakukan Analisis Akar Masalah (RCA) secara menyeluruh dan berdasarkan hasil RCA, terbitkan CAPA. Analisis akar masalah harus menyeluruh menggunakan beberapa metodologi, dan berdasarkan RCA Anda dapat membuat CAPA. Terkadang CAPA muncul begitu saja karena merupakan solusi termudah. Namun, analisis akar masalah merupakan bagian penting dalam membangun kompas yang baik.

Solusi
Elemen mendasar dari QMS yang siap diperiksa.
Fasilitas dapat memastikan QMS siap diperiksa dengan menerapkan prosedur pengendalian mutu yang tepat, termasuk SOP tertulis yang jelas untuk menilai kesesuaian komponen dan penutup, memantau kesesuaian lingkungan produksi, dan menilai kelayakan produk manufaktur untuk dirilis. SOP harus dipatuhi, dan unit QC harus memberikan dokumentasi akurat atas penilaian mereka.
Unit jaminan mutu harus memiliki kewenangan untuk mengawasi semua operasi di dalam fasilitas terkait produk yang diproduksi. Harus ada SOP yang ketat untuk memungkinkan tim QA meninjau dan menyetujui semua praktik yang terkait dengan produksi. Personel QA harus memiliki kewenangan untuk mengakses kualitas produk dengan meninjau SOP, catatan pemeliharaan dan kalibrasi, catatan produksi batch, dan catatan pengujian. Terakhir, unit QA harus menyetujui atau menolak semua produk yang diproduksi untuk dirilis dan juga harus berperan dalam mengaudit semua area fasilitas untuk memastikan kepatuhan.
Cara menerapkan Sistem Manajemen Dokumen Mutu yang Sesuai dengan FDA
Sistem Manajemen Mutu berbasis kertas Anda mungkin dapat memenuhi persyaratan regulasi, tetapi itu tidak berarti Anda memiliki Sistem Manajemen Mutu yang tangguh. Memiliki sistem untuk membangun struktur yang lebih konsisten dalam membuat prosedur, yang dapat Anda gunakan untuk memberikan pelatihan yang lebih efektif. Mari pelajari beberapa kiat untuk membangun struktur prosedur yang konsisten:
- Ketahui tujuan Anda . Apa hasil yang Anda inginkan?
- Tentukan cakupannya . Kapan prosedur akan digunakan dan kapan tidak? Apa yang digunakan sebagai alternatif?
- Tetapkan tanggung jawab . Siapa yang akan bertanggung jawab dan dari mana? Uraikan tanggung jawab dan wewenang.
- Tentukan semua istilah dan definisi yang digunakan dan khusus untuk prosedur tersebut.
- Tentukan referensi Anda . Bagaimana prosedur ini berinteraksi dengan prosedur lainnya?
- Tentukan risikonya . Risiko apa saja yang ditangani oleh prosedur ini dan bagaimana risiko tersebut memengaruhi desain prosedur?
- Tentukan prosedur dengan diagram alir dan instruksi. Uraikan prosesnya.
- Tentukan di mana catatan disimpan dan bagaimana cara mengaksesnya.
- Berikan contoh untuk kejelasan jika perlu.
- Uji prosedur dan evaluasi. Perbarui jika perlu.
- Tentukan periode revisi
- Tentukan persetujuan dan peninjauan.
Solusi QMS Scilife yang komprehensif membantu Anda tetap siap diperiksa setiap saat dengan tanda tangan elektronik yang sesuai dengan Bagian 11 , alur kerja peninjauan dan persetujuan yang fleksibel, kontrol revisi, dan banyak lagi. Anda akan dapat memberikan apa pun yang mereka minta dengan tanda tangan dan bukti objektif yang mereka butuhkan segera setelah mereka memintanya. Tidak perlu lagi mengejar catatan yang hilang atau hilang.
Kesimpulan
Selain semua kiat yang telah kami berikan sejauh ini, mengadakan rapat informal tambahan dengan semua peserta yang terlibat dalam audit merupakan kegiatan yang sangat efisien untuk menemukan area perbaikan. Dalam rapat tersebut, Anda harus mengumpulkan semua wawasan, pengamatan, pelajaran yang dipetik, poin-poin penting, dll. yang mungkin telah dilihat oleh inspektur tetapi terlewatkan. Ini akan memberikan keajaiban! Hal-hal yang tidak Anda sadari akan terungkap, dan Anda dapat mengumpulkan semua risiko, perbaikan, masalah, dll. Ini juga memberikan kesempatan yang baik untuk berterima kasih kepada semua karyawan Anda atas upaya dan keterlibatan mereka dalam budaya mutu. Pantau tindakan audit internal dan selesaikan sebanyak mungkin agar dapat bersiap dengan lebih baik!
Akhirnya, setelah Anda mempelajari apa yang tertulis dalam laporan dan apa yang tercantum dalam rapat internal informal, sekarang saatnya untuk bertindak bijak. Anggap inspeksi FDA sebagai kesempatan untuk belajar dan memperbaiki diri dengan mengikuti daftar periksa inspeksi FDA yang komprehensif ini dan mematuhi kiat-kiat yang diberikan. Dengan melakukannya, Anda dan organisasi Anda akan dapat menavigasi proses inspeksi dengan percaya diri dan menjadi lebih kuat serta lebih patuh daripada sebelumnya.





Tidak ada komentar:
Posting Komentar